LES
SYNTHESES
Plan
de l’étude :
Plan général des synthèses
ACETALS :
Les
hémiacétals et les acétals sont les produits d’addition des alcools aux
aldéhydes.
Exemple :
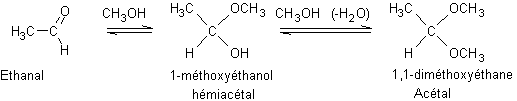
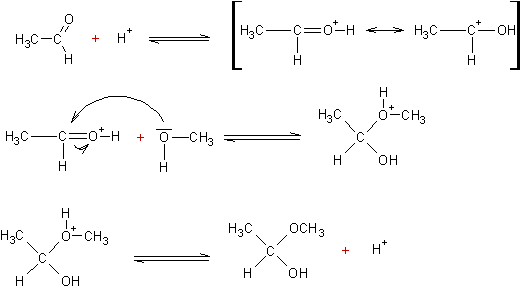
FORMATION
D’UN HEMIACETAL :
Cette
réaction peut être catalysée par un acide ou une base.
·
Le mécanisme par catalyse basique est
le suivant :

·
Mécanisme par catalyse acide :
FORMATION
D’UN ACETAL :
Contrairement
à l’hémiacétal, la formation des acétals n’est catalysée que par les acides.
·
Le mécanisme est le suivant :
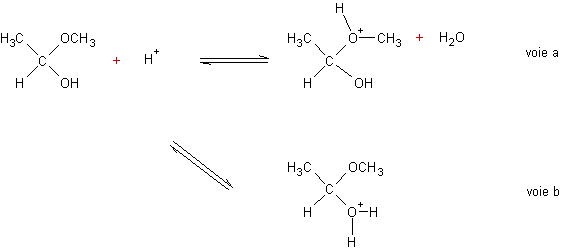
Première
étape :
deux voies sont possibles : protonation de l’oxygène de O-CH3,
ou bien protonation de l’oxygène du O-H :
Deuxième
étape :
v Le
composé obtenu par la voie a peut perdre CH3OH et donner l’acide
conjugué de l’éthanal ; c’est le mécanisme de la réaction inverse de
formation de l’hémiacétal par catalyse acide :
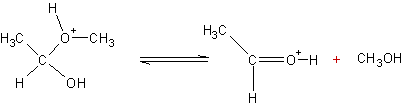
v Le
composé obtenu par la voie b peut perdre de l’eau :

Les
acétals sont stables en milieu basique du fait que leur formation n’est
catalysée que par les acides.
|
|
|
v Par l’ozone :
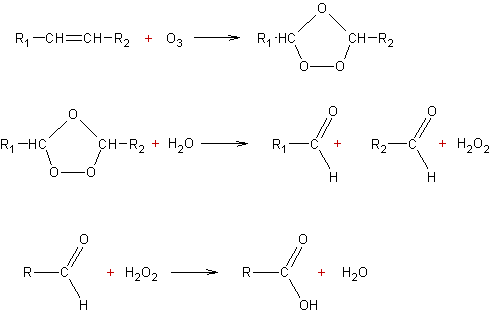
v Par d’autres oxydants :
D'une
façon générale
:
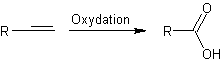
Exemple
1
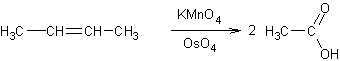
Exemple
2
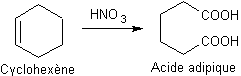
·
Oxydation des alcools primaires :

Exemple :
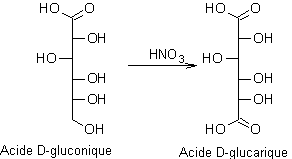
·
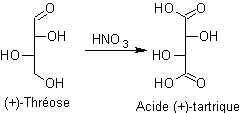
Oxydation des aldéhydes :
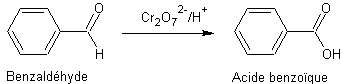
En solution

Exemple
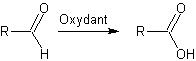
D'une
façon générale
:
Exemple
1
Exemple
2
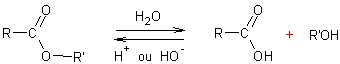
·
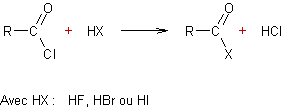
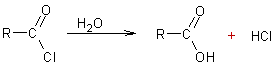
Hydrolyse des chlorures d’acyle :
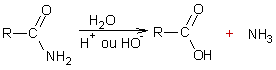
·
Action de CO2 sur un
organomagnésien :
![]()
·
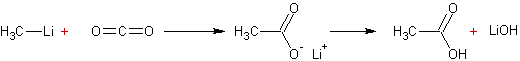
Action de CO2 sur un
organolithien :
![]()
Exemple
1 :
Exemple
2 :
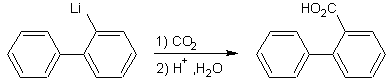
Exemple
3 :
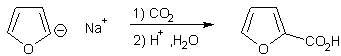
·
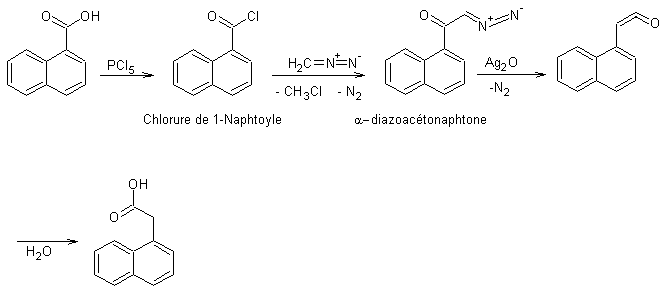
Action d’un chlorure d’acyle sur le
diazométhane (réaction de
Arndt-Eistert) :
La synthèse de Arndt-Eistert permet de passer d’un
acide à son terme supérieur : -CO2H → -CH2CO2H
·
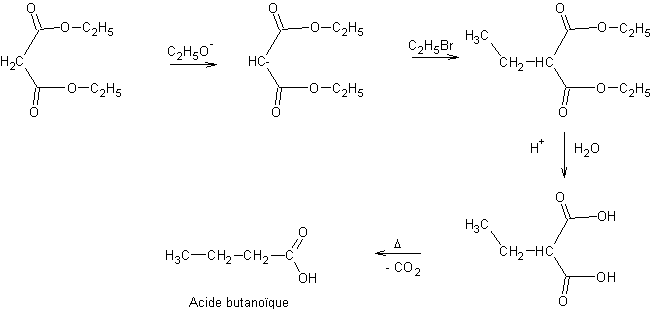
A partir des esters acétoacétiques :

Remarque
1 :
Par
chauffage de l’acide obtenu, on assiste à une décarboxylation (-CO2)
qui conduit à une cétone :
![]()
Remarque
2 :
Si
l’on mène l’hydrolyse en milieu basique, on aboutit à des produits
différents :

·
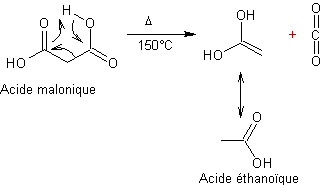
A partir des esters maloniques :
Exemple
1 :
Exemple
2 :
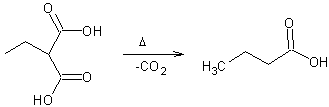
·
A partir des méthylcétones (réaction haloforme) :
Exemple 1 :
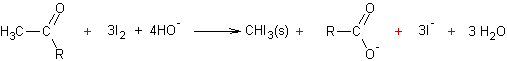
Exemple
2 :
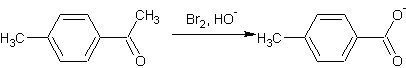
·
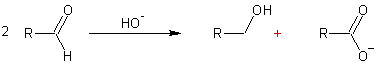
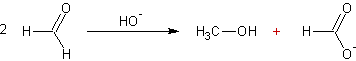
Par réaction de Cannizzaro :
En milieu basique deux molécules d’aldéhyde n’ayant pas d’hydrogène en α donnent lieu à une réaction de dismutation (l'une est oxydée, l'autre est réduite) appelée réaction de Cannizzaro :
Exemple
1
![]()
·
A partir d’une cétone par oxydation
par un peracide (réaction de
Baeyer-Villiger) :
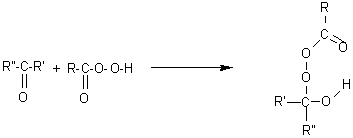
Il
s'agit de l'oxydation d'une cétone par un acide peroxycarboxylique ; après
addition de l'acide qui aboutit à l'analogue peroxydé d'un hémiacétal, il y a
transposition cyclique qui conduit à un ester.
1èreétape: addition
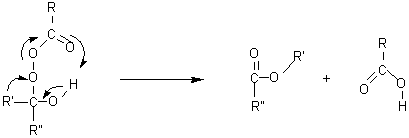
2èmeétape : Transposition
cyclique
Ainsi la
butan-2-one(![]() )
devient l'éthanoate d'éthyle(
)
devient l'éthanoate d'éthyle(![]() )
)
Lequel des deux
groupes R' ou R" migre? C'est le plus substitué (C tertiaire migre plus
facilement que C secondaire, lui même plus facilement que C primaire.)
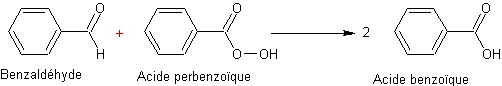
Les agents
oxydants les plus communément utilisés sont: l'acide perbenzoïque C6H5CO3H,
l'acide peracétique CH3CO3H, l'acide
trifluoroperacétique CF3CO3H.
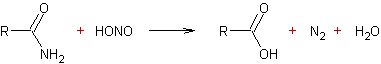
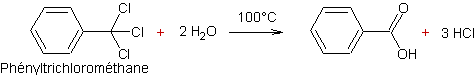
- Oxydation par le dibrome :
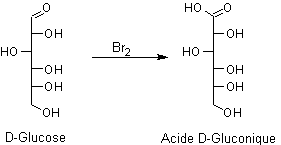
Exemple
1
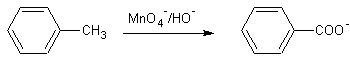
Exemple
2
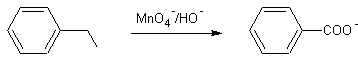
Exemple
3
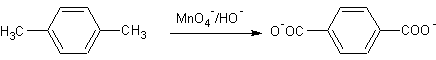
|
|
|
·
Addition des organo-métalliques sur :
v Des chlorures d’acyle :

v des aldéhydes :

v des anhydrides :

v Des éthers cycliques :
Cycles à 3 ou 4 atomes seulement.

v Des esters :
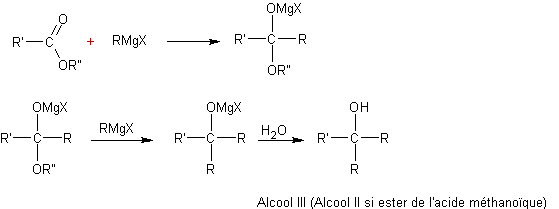
v Des cétones :

·
Oxydation des organo-métalliques :
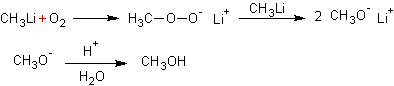
2ème
exemple :
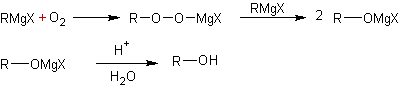
·
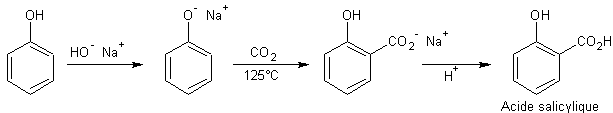
Addition des phénols au méthanal :
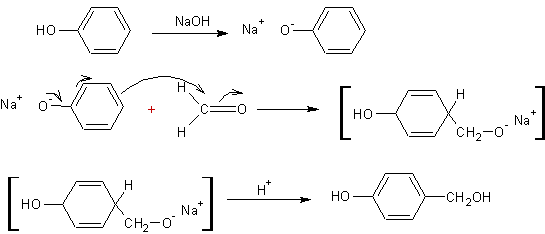
·
Réaction des amines avec l’acide
nitreux :

![]()
Deuxième exemple :
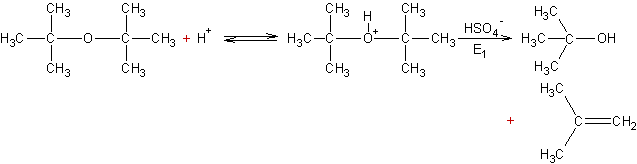
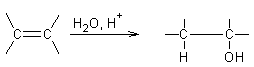
·
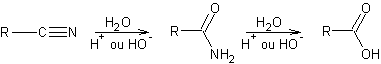
Hydrolyse des halogénures d’alkyle :
![]()
·
Hydrolyse des halogénures d’allyle :

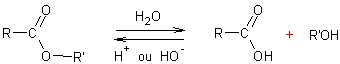
·
Hydroxylation des cycloalcanes par le
permanganate :
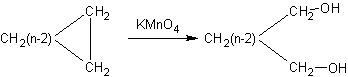
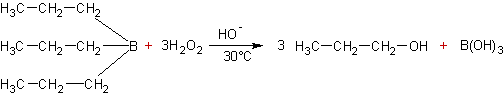
·
Réarrangement des hydroperoxydes :

·
Réduction des chlorures d’acyle par
des hydrures
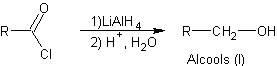
v
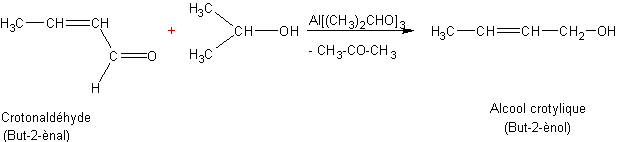
Par
des alkoxydes d’aluminium (Meerwein-Ponndorf-Oppenauer-Verley)
v Par les hydrures
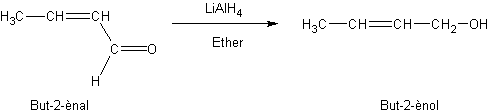
v
Par
l’hydrogène
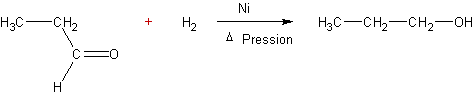
v Par le sodium dans l’éthanol
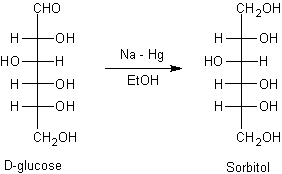
v
Réaction
de Cannizzaro
Dismutation d'un aldéhyde sans H en
α du carbonyle en présence d'une base forte.
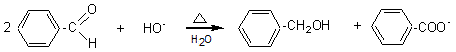
En milieu basique deux molécules
d’aldéhyde n’ayant pas d’hydrogène en α donnent lieu à une réaction de
dismutation (l'une est oxydée, l'autre est réduite) appelée réaction de Cannizzaro :
·
Réduction des alcènes par les
borohydrures :
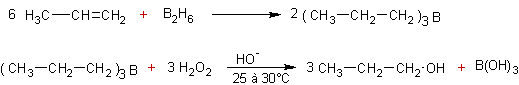
·
Réduction des anhydrides par les
hydrures :
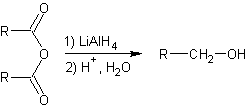
·
Réduction des acides carboxyliques par les hydrures :
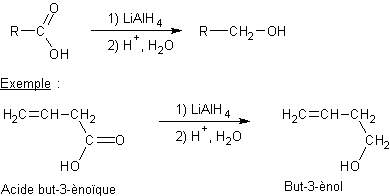
·
Réduction des esters carboxyliques par :
v Les hydrures :
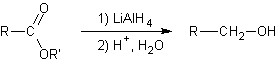
v L'hydrogène :
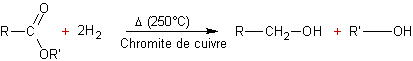
v Sodium dans l'éthanol :
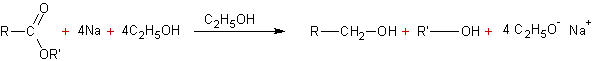
·
Réduction des éthers cycliques par les hydrures
:
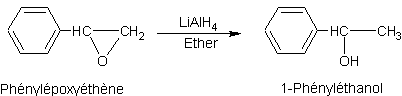
·
Réduction des cétones :
v Par les alkoxydes d'aluminium

v Par les hydrures
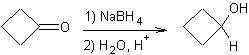
v Par l'hydrogène
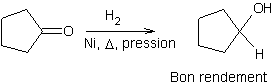
·
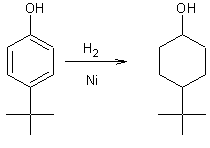
Réduction des phénols par l'hydrogène
:
·
Condensation des acides carboxyliques
et des amines (ou
de l’ammoniac) :
v 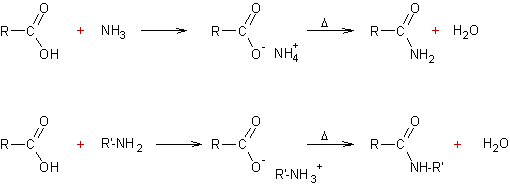
·
Condensation des anhydrides et des
amines (ou de l’ammoniac) :
v 
·
Condensation des esters et des amines
(ou de l’ammoniac) :

·
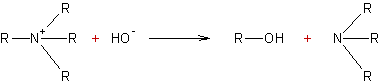
Condensation des halogénures d’alcoyle
avec les amines :
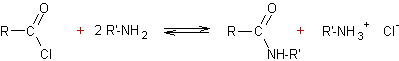

·
Addition de nitriles aux alcènes (réaction de Ritter)

·
Addition des organo-magnésiens aux
isocyanates :
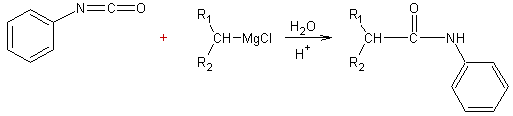
·
Réarrangement des oximes (Beckmann)
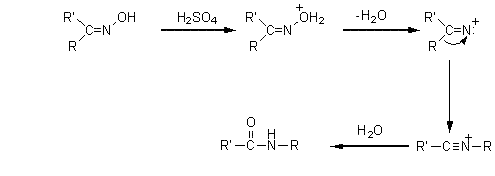
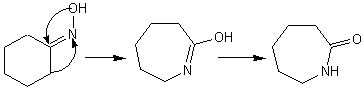
L'oxime
de la cyclohexanone conduit au caprolactame qui sert à préparer des fibres
textiles artificielles (perlon):
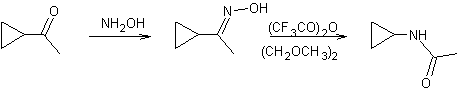
Autre
exemple :
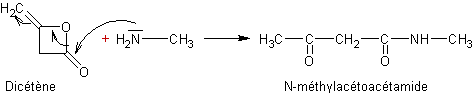
·
A partir des acides carboxyliques :
v
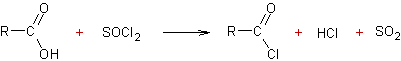
v
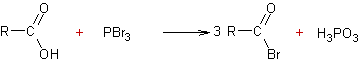
v
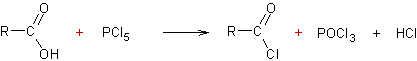
v
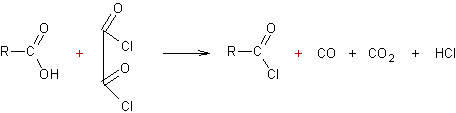
·
A partir des anhydrides d’acides :
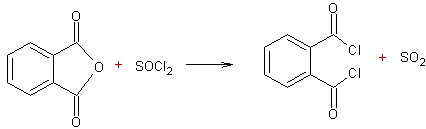
·
Transhalogénation :